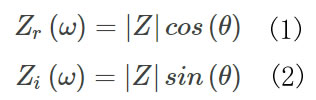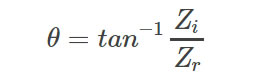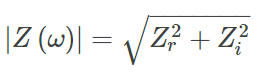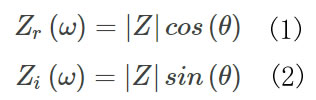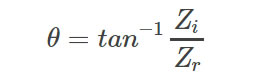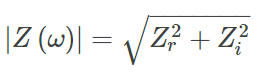腫瘤患者來源的異種移植(PDX)是進行化療藥物敏感性和毒性評估的有效手段����,對預測化療療效至關重要�。細胞凋亡或程序性細胞死亡可為吞噬細胞清除細胞提供重要信號,也可調控廣泛微環(huán)境中細胞信號轉導�����。細胞凋亡首先在細胞表面形成質膜泡�����,隨后產生薄膜包埋,包括質膜上的微管峰�����、凋亡和珠狀結構��,最終導致細胞分裂和細胞物質分布到亞細胞體和小微泡中�����。所有這些具有不同大小���、形狀和內部組成的膜結合凋亡細胞外小泡(1-5μm)統(tǒng)稱為凋亡小體(ABs)�。在藥物處理下分泌到培養(yǎng)基中的亞細胞凋亡小體(ABs)和微泡(MVs)����,可作為藥物敏感性的標志物��。目前����,實體瘤的體外藥物敏感性評估主要通過:一����、對貼壁細胞進行顯微鏡鏡檢分析ABs細胞的數量和形狀�;二、流式細胞儀測量統(tǒng)計凋亡條件下ABs和細胞的數量��,并根據熒光染色結果鑒定細胞大小并進行分類���。然而由于ABs復雜多樣���,很難確定每種AB型的適配熒光染料并預估ABs對不同染料滲透動力學的依賴性,因此利用流式細胞儀量化細胞分解過程存在極大的挑戰(zhàn)�����。阻抗流式細胞儀(Ampha Z32����,Amphasys AG)作為一種測量單細胞電生理學特性的有效工具,已廣泛應用于無標記高通量無損評估細胞的活力與數量��。近期�����,美國弗吉尼亞大學的科研人員利用阻抗流式細胞儀Ampha Z32測定分析了經吉西他濱處理的胰腺腫瘤培養(yǎng)基上清液中ABs,所得測量結果(高頻阻抗相位與大小分布)與常規(guī)方法提取出的凋亡細胞所表現出表型特征一致�,結合介電質多殼模型還可用于ABs分類(基于尺寸和形狀),如:具有低阻抗相位(<0.3)的<2.6μm小球形囊泡���;具有高阻抗相位(<0.5)的中等尺寸扁球形囊泡(3-8μm)����;以及可能由球形或長形囊泡產生的具有低阻抗相位(<0.3)的較寬尺寸囊泡(3-14μm)��,這是常規(guī)流式細胞儀(FACS Calibur��,BD Biosciences)所不能實現的�����?��?梢?,阻抗流式細胞儀(Ampha Z32����,Amphasys AG)可作為檢測胰腺腫瘤微環(huán)境模型培養(yǎng)基中的ABs的有效工具��,準確評估患者源性腫瘤對化療藥物的藥物敏感性和毒性。
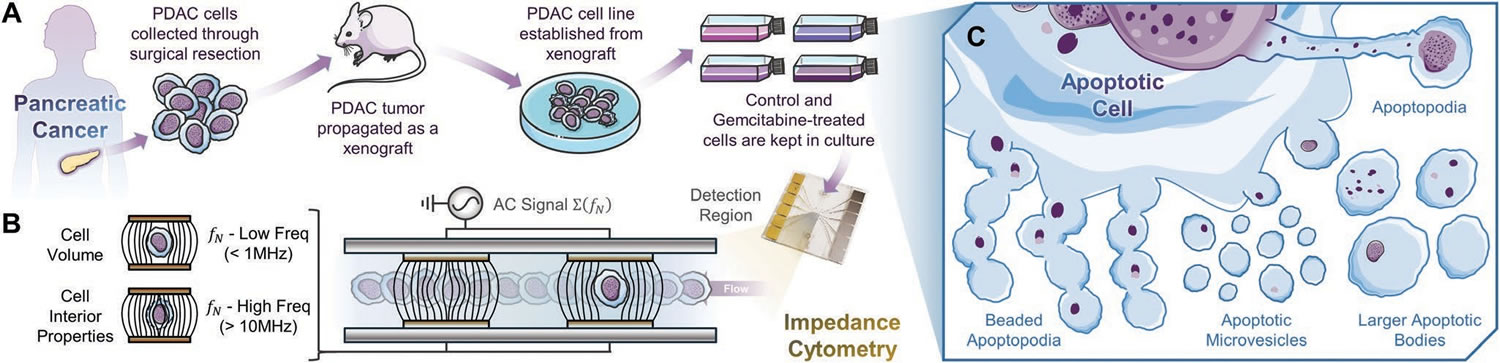
圖1 A)建立胰腺癌(PDAX)患者來源的異種移植模型測定對吉西他濱的藥物敏感性��;B)阻抗流式細胞儀(Ampha Z32��,Amphasys AG)檢測示意圖�;C)吉西他濱誘導凋亡細胞解體產生的各種表型和形態(tài)的凋亡小體ABs
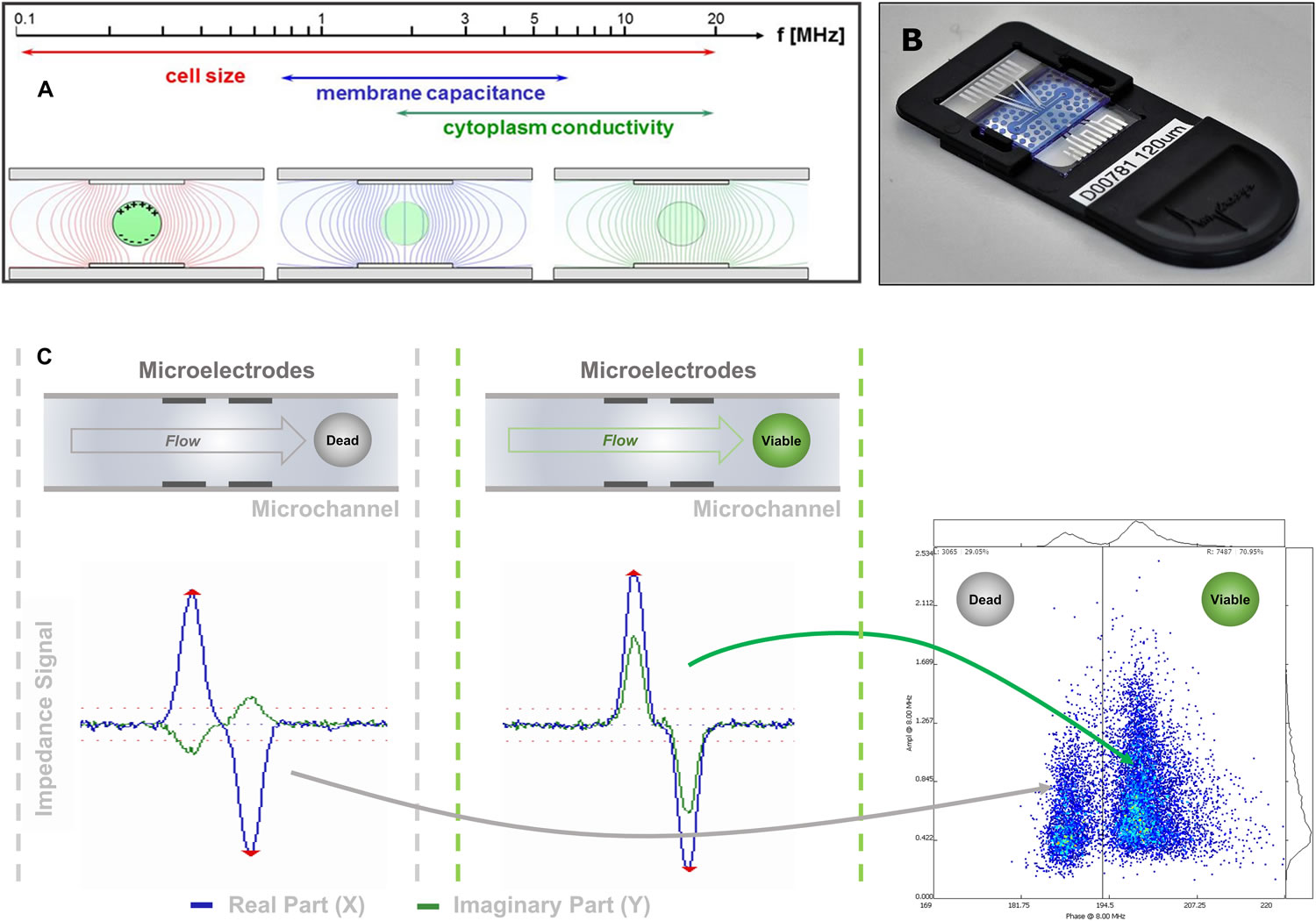
圖1B 阻抗流式細胞儀(Ampha Z32,Amphasys AG)信號的采集和轉導A)細胞在不同頻率的交流電場中的檢測結果���,低頻下反映細胞的體積特性��,高頻下反映細胞膜的介電特性即細胞活性����;B) 微流控芯片����;C)流經交流電場的細胞的阻抗信號(藍色實部即電阻信號,綠色虛部即容性電抗信號)�,細胞膜完整性決定容性電抗的大小,故可通過虛部信號來區(qū)分活細胞和死細胞���,最終以阻抗相位角-振幅散點圖反映出來阻抗流式細胞儀(Ampha Z32���,Amphasys AG)�,通過檢測流經交流電場的細胞懸浮液中細胞的電阻抗信號����,分析獲得細胞的數量、大小�����、活性�����。該儀器可以在0.3-30MHz的范圍內同時測量4個不同頻率下細胞的電阻抗特性����,適配微流控芯片通道尺寸范圍為15-400μm(圖1B),可滿足0-300μm范圍內的任意生物�����、非生物單細胞的活性測量�。電場中活細胞的等效電路由電阻(細胞質)和電容(細胞膜)組成,在笛卡爾坐標系中��,阻抗Z(ω)可以描述為實部分Zr(ω)或電阻與虛部分Zi(ω)或容性電抗的矢量和。
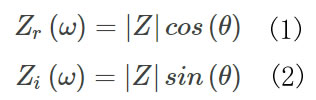
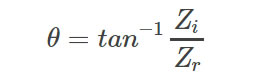
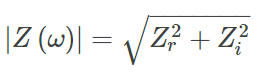
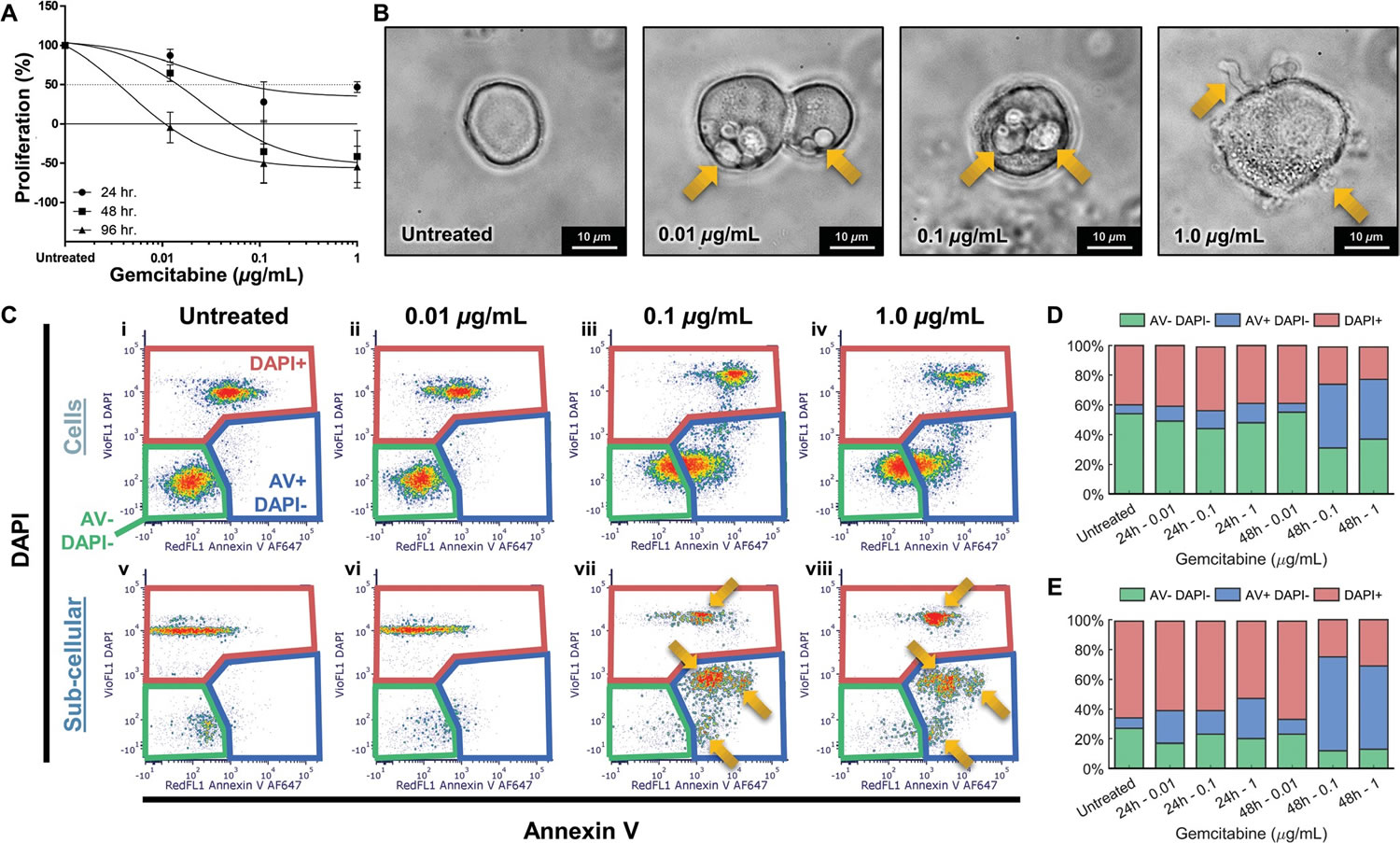
圖2 流式細胞儀(FACS Calibur�����,BD Biosciences)評估吉西他濱誘導下PDAC細胞系的凋亡變化
其中圖2A)顯示了暴露于不同濃度(0.01�、0.1和1 μg·mL-1)吉西他濱下的PDAC細胞系在不同處理時間[24 h(●)����、48 h(■)和 96 h(▲)]的相對于對照組的增值狀態(tài)(%)。從圖中可以看出�,0.01 μg·mL-1的藥物濃度下,短時間內(24 h和48 h)幾乎對細胞增殖無影響����,而0.1和1 μg·mL-1的藥物濃度下48h和96h后,細胞增殖水平急劇下降至≈-50%����。也就是說隨藥物劑量增加和暴露時間的延長,細胞增殖下降�,這說明吉西他濱對PDAC細胞系有化療效果。圖2B)為不同濃度吉西他濱下暴露48h后的PDAC細胞顯微圖像(63 obj���,2.5optovar�����,Zeiss Observer 7)���,其中凸起(0.01 μg·mL-1)�、氣泡(0.1 μg·mL-1)及珠狀結構(1 μg·mL-1)均為細胞凋亡過程的關鍵特征���,會進一步形成具有特定組成和結構的ABs����。圖2C)對不同濃度吉西他濱下暴露48h后的PDAC細胞進行流式細胞分析所得到細胞(i-iv)和亞細胞(v-viii)的密度散點圖���。其中膜聯(lián)蛋白V (AnnexinV)與DAPI作為染色標記物����。圖中AV-DAPI-門控內為未染色的活細胞���;AV+DAPI-門控內為細胞膜完整的處于凋亡早期至中期的細胞����;DAPI+門控內為具有通透性膜的失活細胞����。圖2D)和E)分別為不同濃度不同暴露時間下���,細胞(Cells)和亞細胞(Sub-Cells)中AV-DAPI-、AV+DAPI-和DAPI+門控中的亞群占比�。其中在高濃度吉西他濱治療條件下(48 h�,0.1和1 μg·mL-1),DAPI+細胞的比率降低�,其中AV+DAPI-細胞(即早期/中期凋亡細胞)的比率顯著增加(圖2D),表明此時藥物開始誘導的細胞凋亡���;AV+DAPI-亞細胞比例從≈10–30%上升至≈60%(圖2E)�����,這可能對應于凋亡細胞分解過程中產生的較大的ABs���。圖2C-vii、viii中的箭頭指示出不同的ABs亞型�,但由于遺傳物質和膜構象的差異,不同ABs亞型需要適配不同的染色劑���,故很難通過流式細胞儀進行具體區(qū)分�����。
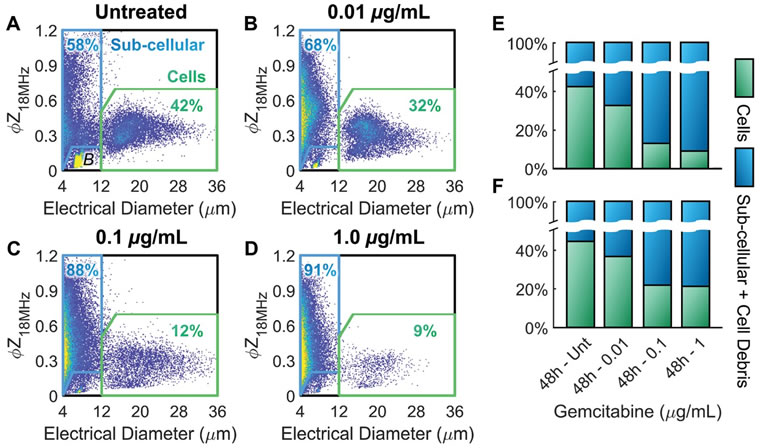
圖3 阻抗流式細胞儀(Ampha Z32��,Amphasys AG)評估吉西他濱誘導下PDAC細胞系的凋亡變化圖3中A-D分別為不同濃度(0�、0.01、0.1和1 μg·mL-1)的吉西他濱下暴露于48 h后的PDAC細胞電直徑與阻抗相位的密度散點圖���。其中�����,阻抗流式細胞儀在低頻電場(0.5 MHz)下測量得到的細胞阻抗振幅(IZI)可用于評估細胞的電直徑()����,而在高頻電場(18 MHz)下的阻抗相位()則可用來評估細胞的介電特性�,7 μm聚苯乙烯珠的電直徑-阻抗相位值可作為參考設置細胞和亞細胞門控。圖E)和F)分別顯示了在不同濃度藥物下��,阻抗流式細胞儀和流式細胞儀分析獲得的細胞和亞細胞的占比���,從圖中可以看出����,0.1和1 μg·mL-1藥物水平下的細胞占比顯著下降(*p<0.05),這是由于藥物治療下��,PDAC細胞凋亡并促使亞細胞凋亡小體ABs的釋放����。
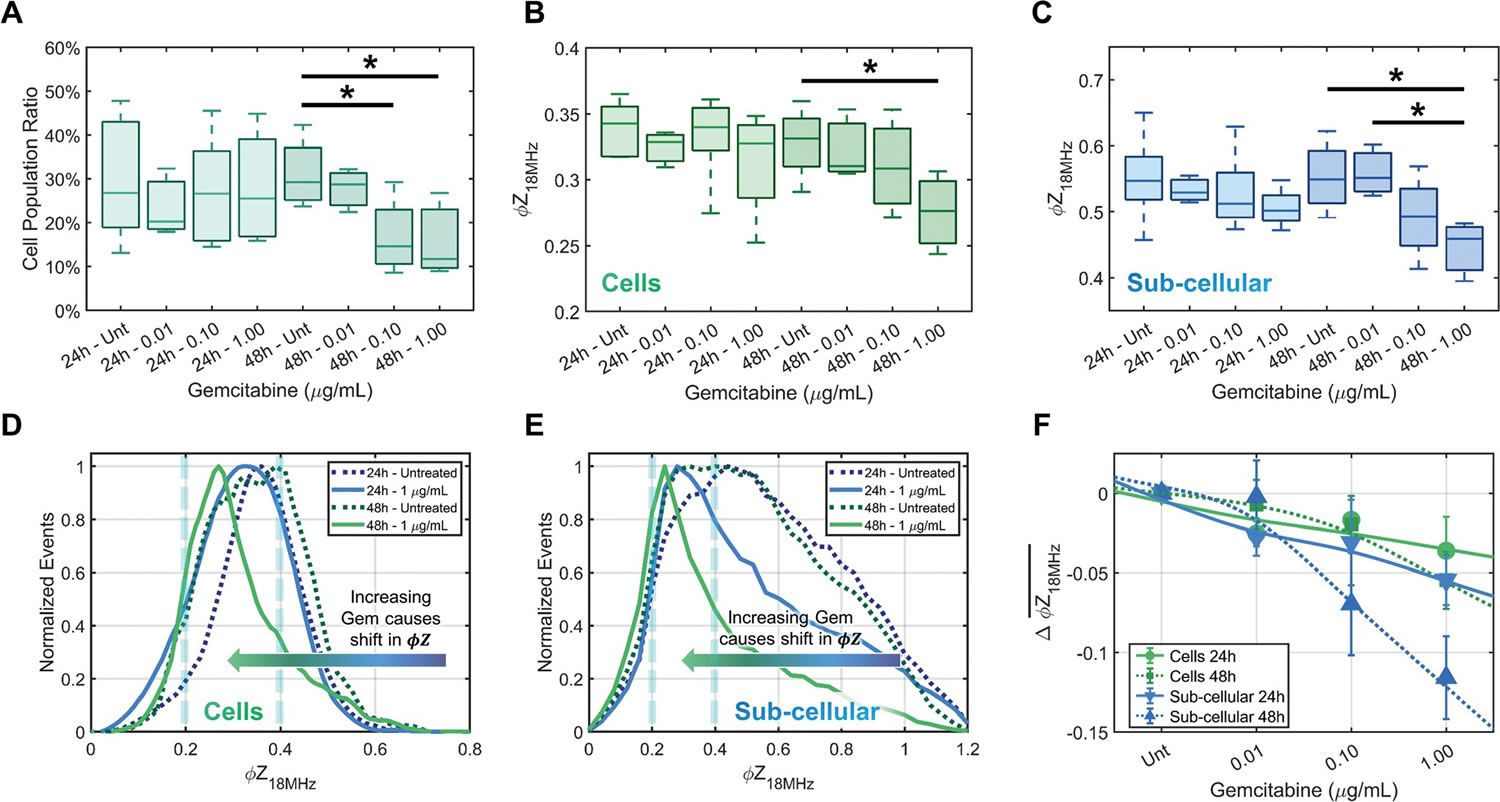
圖4 A-C分別為不同藥物濃度、不同暴露時間下����,A)細胞亞群的占比的變化��;B)細胞的阻抗相位變化以及C)亞細胞的阻抗相位變化��;D)細胞與E)亞細胞的歸一化阻抗相位(φZ18 MHz)分布趨勢(對照組與暴露于1 μg·mL-1吉西他濱下24 h和48 h的處理組�����,以7 μm聚苯乙烯珠在18 MHz下的阻抗相位(φZ18 MHz)為參考進行標準化處理)�����;F)暴露于不同濃度吉西他濱下24 h和48 h的細胞和亞細胞與對照組的差分阻抗相位比較���。從圖中可以看出�,細胞及亞細胞阻抗相位均隨著藥物濃度升高及暴露時間的延長而降低,這是由于隨細胞的凋亡��,細胞內部電導率(σint)下降����,從而反映出細胞阻抗相位的下降,這與使用雙相電泳觀察到的凋亡細胞所反映出的狀態(tài)一致���,這種效應可能與細胞凋亡過程中細胞內離子(主要是K+和Na+)的流出有關����。特別值得注意的是���,阻抗流式細胞儀(Ampha Z32�,Amphasys AG)對細胞凋亡過程的捕捉比流式細胞儀更為靈敏�,其可在較低藥物濃度(和暴露時間)下檢測出細胞阻抗相位的變化(圖4D、E與圖2C��、D)�。總體來看���,細胞和亞細胞的歸一化阻抗相位(圖4D���、E)分布趨勢相似����,但亞細胞群體的阻抗相位下降幅度更大�,這說明兩個類群的表型相似,但亞細胞對凋亡的發(fā)生更加敏感�����。根據阻抗相位的變化��,或可進一步進行各種ABs亞型����,如:較小的微泡�、ABs珠狀聚集體和細胞解體產生的較大ABs(圖1C)的分類研究。
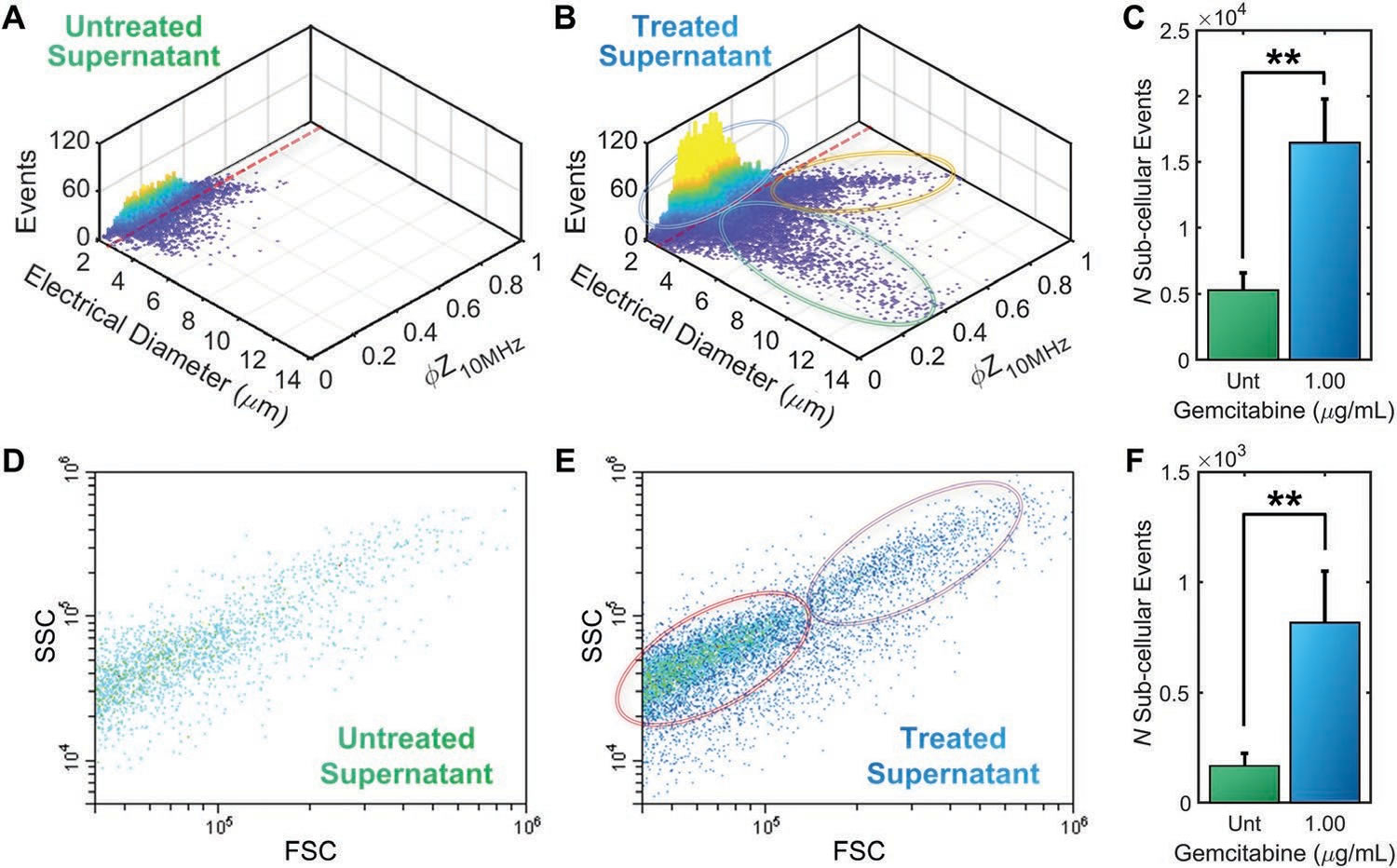
為優(yōu)化阻抗流式細胞儀(AmphaZ32��,Amphasys AG)單細胞檢測的信噪比��,以識別不同ABs亞型的電生理學的差異�����,本研究利用5μm聚苯乙烯參考珠的檢測結果進行尺寸標準化,并結合單一頻率的(10 MHz)阻抗相位和電直徑結果繪制了對照組(圖5A)和1 μg·mL-1吉西他濱處理組(圖5B)的ABs電直徑-阻抗相位3D密度分布圖�。對比可見,對照組與處理組細胞數量存在顯著差異(圖C�����,**p<0.01)�,且處理組含有三個不同ABs亞群:低阻抗相位的小囊泡(<0.3)、高阻抗相位的中型亞細胞體(>0.5)和低阻抗相位的較大尺寸的亞細胞體(<0.3)���。流式細胞儀的檢測結果同樣顯示出對照組與處理組細胞數量間的顯著差異(圖F���,**p<0.01),但卻無法從FSC��、SSC或膜聯(lián)蛋白V染色結果進行ABs亞群尤其是較大尺寸(中值電直徑>2.6 μm)亞群的區(qū)分(圖5D����,F)。
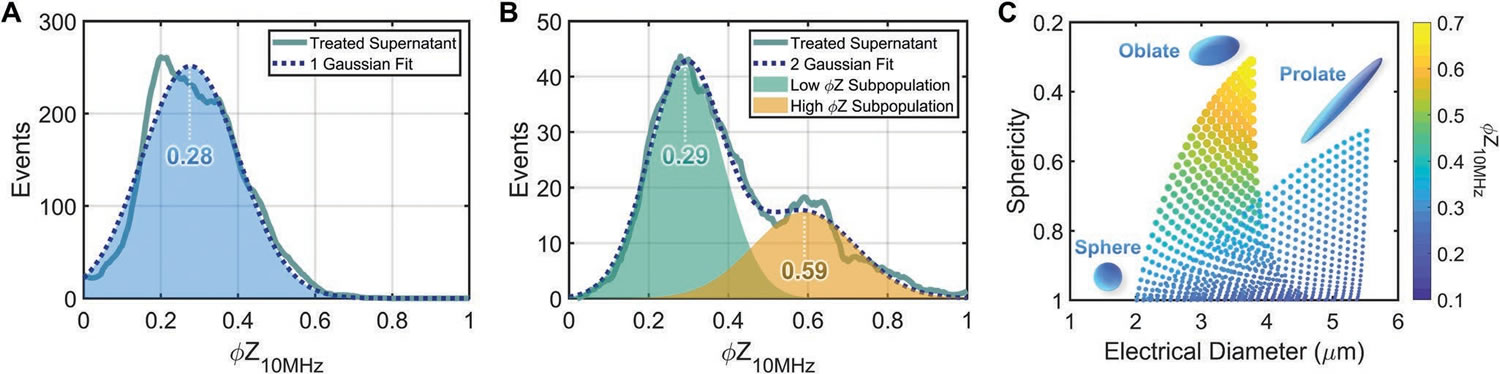
暴露于1 μg·mL-1吉西他濱下48 h的處理組ABs在10 MHz下的阻抗相位分布如圖中圖6A)和B)中實線所示�。為對ABs表型進行準確分類,本研究通過單一高斯分布(圖6A�,A-1高斯模型R2=0.9686)來擬合確定<2.6 μm的ABs亞群的阻抗相位分布的峰值位置(0.28),通過雙高斯分布(圖6B虛線,B-2高斯模型R2=0.9852)擬合確定電直徑>2.6 μm的ABs亞群(對應圖5B的兩個亞群)阻抗相位分布的峰值位置(0.29和0.59)�。顯微鏡觀察到亞細胞體呈球形、扁長形和扁圓形(圖1C)等多種亞型����,形狀因細胞系、藥物誘導等因素而異�����。我們雖然很難通過阻抗流式細胞儀直接識別出這些形狀特征��,但卻可以利用不同形狀對電極化的強烈影響而產生的阻抗數據差異進行形狀的區(qū)分��。本研究基于ABs球形度-電直徑變化所引起的阻抗相位(φZ10 MHz)的變化創(chuàng)建了ABs表型的介電多殼模型�����,該模型(圖6C)可顯示特定大小和形狀下的ABs阻抗相位(φZ10 MHz)的差異�,其中有低阻抗相位(<0.3)的<2.6μm的為小球形囊泡,高阻抗相位(<0.5)的中等尺寸扁球形囊泡(3-8 μm)��,以及可能由球形或長形囊泡產生的具有低阻抗相位(<0.3)的較寬尺寸的囊泡(3-14 μm)�。此研究表明��,阻抗流式細胞儀可高通量快速無損評估患者源性腫瘤細胞對藥物的敏感性����,不僅免除了費力耗力的細胞收集和染色標記過程�����,還可避免因染色不當所造成的細胞凋亡����。除此之外��,阻抗流式細胞儀還可在不同的腫瘤微環(huán)境模型和藥物類型下通過追蹤ABs表型來確定細胞凋亡過程��,以更準確的衡量藥物敏感性和毒性�����。